1. Introduction
Ces dernières décennies, la recherche s’est de plus en plus intéressée à des matériaux alternatifs, biodégradables et écologiques pour diverses applications scientifiques. Les biopolymères tels que la cellulose, l’amidon, les gélatines et le chitosane ont suscité un vif intérêt en raison de leurs caractéristiques intéressantes, notamment leur biodégradabilité, leur biocompatibilité et leur non-toxicité pour l’homme [ 1 , 2 ]. Le chitosane est le principal dérivé de la chitine. Il a été découvert dans les champignons par Henri Braconnot en 1811, qui l’a baptisé « fongine ». Plus tard, en 1821, Auguste Odier a isolé le même composé à partir de cuticules de coléoptères et l’a baptisé « chitine » [ 3 , 4 ].
La chitine fut ainsi le premier polysaccharide identifié par l’homme, précédant la cellulose d’environ 30 ans, et le polymère le plus abondant après cette dernière. En effet, la chitine est le composant le plus abondant dans l’exosquelette des arthropodes et dans les membranes structurales et les spores des champignons [ 2 , 5 ]. Les crevettes et les crabes, caractérisés par une teneur élevée en chitine (environ 20 à 30 %), sont les sources commerciales les plus courantes de ce polysaccharide, bien que leur utilisation comme source de chitine ait été récemment largement débattue [ 6 , 7 ].
Alors que la demande mondiale de chitosane augmente, avec un taux de croissance annuel de 15,4 %, il est nécessaire de trouver des sources alternatives pour répondre à la demande du marché. Ces dernières années, la recherche s’est également concentrée sur l’étude des insectes, caractérisés par 10 à 15 % de chitine, comme source alternative de cette dernière [ 8 ]. L’extraction de la chitine des insectes est également avantageuse en termes de méthode d’élevage, de consommation de substance et de temps de production [ 9 ]. Les espèces d’insectes les plus étudiées pour la production de chitosane sont Hermetia illucens (Linnaeus, 1758) (Diptera Stratiomyidae), Tenebrio molitor (Linnaeus, 1758) (Coleoptera Tenebrionidae) et Alphitobius diaperinus (Panzer, 1797) (Coleoptera Tenebrionidae). La production de chitosane à partir de chitine, quelle que soit sa source, se caractérise principalement par trois étapes d’extraction : déminéralisation, déprotéinisation et désacétylation [ 2 , 9 ]. Cependant, différentes conditions au cours du processus d’extraction, telles que la concentration des réactifs, le temps et la température, le pH, la présence ou l’absence de cations métalliques, le pKa, le poids moléculaire et le degré de désacétylation, peuvent affecter les propriétés du biopolymère [ 10 ].
Le chitosane possède des propriétés antimicrobiennes, antioxydantes et antitumorales bien connues [ 10 , 11 , 12 ], et son application s’est étendue à de nombreux secteurs, notamment les secteurs pharmaceutique, médical, vétérinaire, alimentaire et agricole. Dans l’industrie pharmaceutique, le chitosane est utilisé dans les formules de médicaments pour prévenir l’irritation de l’estomac grâce à ses propriétés antiacides et antiulcéreuses [ 2 ]. Dans l’industrie cosmétique, il est utilisé pour les traitements des cheveux et de la peau ; en médecine, il est utilisé pour les implants orthopédiques et parodontaux, et, dans le domaine textile, il est employé pour ses propriétés antistatiques et dans la purification de l’eau [ 1 , 2 , 13 ]. En nutrition animale, le chitosane est utilisé comme antimicrobien pour protéger les aliments pour animaux de la contamination par Escherichia coli et Salmonella spp., tandis que dans l’industrie alimentaire, il est utilisé pour les emballages alimentaires [ 14 ]. En agriculture, le chitosane est appliqué au sol, favorisant l’interaction symbiotique entre les plantes et les micro-organismes et améliorant le métabolisme des fruits et des plantes ainsi que la germination [ 2 , 13 ].
2. Utilisation du chitosane contre les insectes
Le chitosane peut améliorer la disponibilité et la stabilisation de certains insecticides ou plantes, tandis que certains dérivés du chitosane ont démontré une activité insecticide contre divers ravageurs agricoles [ 12 , 15 ]. Pour cette raison, le chitosane est actuellement autorisé dans l’UE comme substance de base active et non toxique pour la protection des plantes en tant qu’alternative écologique et sûre aux pesticides de synthèse (Règlement CE n° 1107/2009) [ 16 , 17 ]. Diverses formulations de chitosane, complétées par des insecticides naturels ou synthétiques, ont été étudiées comme outils de lutte contre les insectes nuisibles dans l’agriculture et la santé publique, mais aussi comme instruments de protection des denrées alimentaires [ 18 , 19 , 20 , 21 ]. En particulier, le polymère a été utilisé dans une variété de formulations, y compris une formulation de chitosane simple pulvérisée sur des feuilles, du bois et du papier, des dérivés de chitosane, des complexes chitosane-métal, des nanoparticules de chitosane chargées d’huiles essentielles (HE) et d’insecticides, un revêtement de chitosane et des formulations de chitosane avec des nématodes.
L’utilisation du chitosane dans différentes formulations a fait l’objet de nombreuses études. L’objectif de cette revue est donc de fournir au lecteur des informations actualisées sur l’utilisation et les applications potentielles des formulations de chitosane, résumées dans le tableau 1 , comme outils de lutte antiparasitaire.
Tableau 1. Formulations de chitosane comme stratégies de lutte contre les insectes nuisibles dans la littérature des 20 dernières années (de 2003 à 2023).
2.1. Chitosane nature
Récemment, certaines études ont montré que le chitosane pouvait contribuer à la lutte contre les insectes nuisibles dans l’agriculture, l’alimentation et la santé publique. Cependant, son activité insecticide semble liée à son effet antimicrobien, qui altère le fonctionnement du microbiote intestinal des insectes.
En fait, Stoffolano et ses co-auteurs ont rapporté qu’une solution de chitosane à 2 % incorporée à un régime artificiel induisait une réduction statistiquement significative de la période de survie de Musca domestica (Linnaeus, 1758) (Diptera Muscidae) de 13 à 4 jours dans le régime témoin. Cette tendance est également confirmée pour Tabanus nigrovittatus (Macquart, 1847) (Diptera Tabanidae) (de 16 à 4,5 jours) et pour Phormia regina (Meigen, 1826) (Diptera Calliphoridae) (de 24 à 6 jours). La mortalité des insectes montrée dans cette étude semble être due à des changements physiologiques et structurels dans le tractus intestinal moyen, même si le mode d’action n’a pas encore été clarifié [ 20 ].
Même Muryeti et ses co-auteurs [ 59 ] ont rapporté que le papier broyé supplémenté en chitosane et administré aux termites a montré une augmentation de leur mortalité par rapport au témoin (mortalité de 80 et 45 %, respectivement). Cela semble être dû au fait que le papier de chitosane interfère avec l’alimentation des termites, perturbant la capacité des protistes symbiotiques dans le tube digestif des termites. Cela a incité la recherche à découvrir l’effet du chitosane sur la diversité et le nombre de protistes dans les intestins des termites. Le chitosane a également été signalé comme étant potentiellement efficace pour préserver le bois contre les termites [ 60 ]. En particulier, dans les travaux de Raji et al. [ 24 ], le bois traité au chitosane a montré une mortalité statistiquement significative contre les termites souterrains de plus de 94 % pour Reticulitermes flavipes (Kollar, 1837) (Blattodea, Rhinotermitidae) lorsqu’il a été exposé pendant 28 jours au chitosane (2 % de concentration). Français Au contraire, pour les autres espèces testées, comme R. virginicus, plus de 90 % de mortalité a été obtenue aux concentrations les plus faibles de chitosane (0,5 %). De plus, dans Telmadarrehei et al. [ 23 ], l’effet du traitement du bois au chitosane a été étudié contre les protistes de Reticulitermes virginicus (Banks, 1907) (Blattodea, Rhinotermitidae). D’après les résultats, les termites du groupe témoin ont montré dix espèces de protistes dans l’intestin postérieur, tandis que dans les spécimens traités au chitosane, la présence de protistes était réduite à seulement deux espèces.
2.2. Revêtement de chitosane
En raison de ses capacités filmogènes et biochimiques, le chitosane est un bon conservateur pour les fruits et légumes frais, selon de nombreuses études [ 61 , 62 ]. De plus, outre son activité antimicrobienne, contrairement à d’autres matériaux d’enrobage, le chitosane nature présente une activité antifongique contre une variété de champignons, notamment Aspergillus niger, Botrytis cinetica et Rhizopus stolonifer [ 63 , 64 ].
L’enrobage de chitosane simple est également sans danger pour les humains [ 65 ] et semi-perméable et a le potentiel de modifier l’atmosphère interne des aliments, par exemple en minimisant les pertes par transpiration, en retardant la détérioration et, ainsi, en prolongeant la durée de conservation de divers aliments [ 66 , 67 ].
En agriculture, des enrobages de chitosane simples ont également été testés pour le traitement des semences et des fruits afin de stimuler la croissance des plantes et de lutter contre les maladies [ 61 , 68 ]. En particulier, certaines études ont rapporté que l’enrobage de chitosane repousse les insectes et inhibe la fixation de certains stades de développement. En effet, dans Salvador-Figueroa et al. [ 25 ] et Limon et al. [ 26 ], un enrobage de chitosane sur des mangues a inhibé le développement des œufs et des larves de mouches des fruits mexicaines, Anastrepha ludens (Loew, 1873) et Anastrepha obliqua (Macquart, 1835) (Diptera Tephritidae). Dans les deux cas, l’enrobage de chitosane a considérablement ralenti le taux de maturation et réduit le poids du fruit. Concernant le mode d’action, les auteurs [ 25 , 26 ] ont indiqué une augmentation de la concentration en composés phénoliques et des échanges gazeux du fruit, tous deux responsables de l’inhibition du développement des œufs et des larves. De plus, en raison des différentes couleurs et de la pénétrabilité des fruits traités, l’enrobage de chitosane s’est comporté comme une barrière, réduisant l’attrait des fruits pour les ravageurs et inhibant la ponte des insectes [ 69 ].
2.3. Enrobage de chitosane aux huiles essentielles
Dans la littérature pertinente des 30 dernières années, les huiles essentielles (HE) ont été proposées comme insecticides et/ou répulsifs écologiques pour les insectes [ 70 , 71 , 72 , 73 , 74 , 75 ] même dans différentes formulations [ 76 ]. Cependant, elles présentent certaines limites d’utilisation en raison de leur volatilité prononcée. Les nanoparticules de chitosane chargées d’HE peuvent améliorer leur bioactivité et leur stabilité en diminuant leur volatilité. En effet, les HE, connues pour leur activité insecticide et insectifuge, ajoutées au chitosane, entraînent une augmentation de leur bioactivité. Français En fait, en appliquant sur le fruit de Psidium guajava (goyavier commun) le film produit en ajoutant 2 % d’HE de citronnelle et, comme excipients d’échafaudage, du polyéthylène glycol (PEG) et de la carboxyméthylcellulose (CMC), la ponte de Bactrocera carambolae (Drew & Hancock, 1994) (Diptera Tephritidae) a été significativement inhibée de 85 % par rapport au témoin [ 28 ]. Dans un travail similaire [ 27 ], des graines de chou enrobées de chitosane, enrichies en acide jasmonique, ont induit une mortalité préimaginale de 57 % de Plutella xylostella (Linnaeus, 1758) (Lepidoptera Plutellidae) et Myzus persicae (Sulzer, 1776) (Hemiptera, Aphididae) avant d’atteindre l’âge adulte, empêchant l’émergence des adultes.
L’enrobage de chitosane chargé de différentes huiles essentielles a démontré des propriétés antiappétantes et antitoxiques, améliorant l’efficacité, la durabilité et la disponibilité des huiles essentielles. En fait, dans Ascrizzi et al. [ 30 ], le film d’enrobage de chitosane, obtenu avec l’ajout d’huile essentielle de Ferulago campestis , testé sur des graines de haricot a montré un effet répulsif dose-dépendant statistiquement significatif (93,3 % de répulsion à la concentration la plus élevée de 57,7 µL/L d’air) contre le ravageur des graines Acanthoscelides obtectus (Say, 131) (Coleoptera Bruchidae), sans entraîner d’effets indésirables sur la germination et la croissance des plants de haricot, mais résultant, en même temps, efficace pour supprimer la germination des graines de mauvaises herbes in vitro.
Pour la protection des aliments frais, le chitosane chargé d’huiles essentielles a été testé comme revêtement protecteur pour préserver la viande contre la ponte de Calliphora vomitoria (Linnaeus, 1758) (Diptera Calliphoridae) [ 29 ]. D’après les résultats, le chitosane à 1 % chargé avec 0,1 % d’huiles essentielles de L. nobilis et P. nigrum (choisies suite à l’analyse du profil sensoriel) a montré un effet protecteur sur la viande avec une réduction statistiquement significative de la ponte de C. vomitoria de 84,9 et 93,3 %, respectivement, pour les deux huiles essentielles par rapport au témoin. De plus, le traitement s’est avéré efficace pour préserver la qualité et la durée de conservation de la viande, retardant la dessiccation de la viande et la peroxydation lipidique de 7 jours.
Hossain et al. [ 31 ] ont développé un revêtement de chitosane contenant huit huiles essentielles différentes également en combinaison avec un rayonnement ionisant (plus précisément un rayonnement gamma à 100 et 300 Gy). Les huiles essentielles d’eucalyptus et d’arbre à thé chargées dans un revêtement de chitosane dans le riz ont montré la plus grande efficacité contre Sitophilus oryzae (Linnaeus, 1758) (Coleoptera Curculionidae), provoquant une mortalité de 100 % aux concentrations les plus faibles de 0,2 µL/mL pour une période d’incubation comprise entre 24 et 48 h. Avec la combinaison du rayonnement gamma, la mortalité des insectes était de 100 % même après 14 jours de traitement, assurant un contrôle complet des parasites pour l’emballage des aliments.
2.4. Enrobage de chitosane dans les emballages actifs
Le chitosane peut également être utilisé comme composé secondaire dans les systèmes d’emballage actif pour lutter contre les insectes nuisibles aux denrées alimentaires [ 77 ]. L’emballage actif fait référence à l’incorporation de certains composés actifs dans le matériau d’emballage, dans ce cas à base de chitosane, pour maintenir la qualité et prolonger la durée de conservation des produits alimentaires. Récemment, De Fàtima Silva et al. [ 32 ] ont développé un matériau d’emballage actif durable basé sur le revêtement d’une surface en carton avec du chitosane et de l’huile essentielle de citronnelle, et ils ont évalué l’activité insecticide sur Sitophilus zeamais (Motschulsky, 1885) (Coleoptera, Curculionidae). En particulier, dans cette formulation, le chitosane, grâce à ses groupes amino, a formé des liaisons hydrogène avec les groupes hydroxyles de la cellulose du carton, offrant une bonne résistance au papier et améliorant les propriétés barrières de la matrice du papier tout en conservant la biodégradabilité, tandis que l’huile essentielle a contribué à un effet anti-insectes. En fait, le matériau d’emballage actif s’est révélé pleinement efficace contre l’attaque du charançon du maïs, avec une toxicité de 100 % observée même 360 heures après le traitement. De plus, la perméabilité à l’air et la capacité d’absorption d’eau du matériau d’emballage actif ont été améliorées par rapport à l’emballage non enduit.
2.5. Chitosane et nématodes
Les nématodes entomopathogènes (EPN) sont utilisés dans les programmes de lutte biologique traditionnels, de conservation et supplémentaires [ 78 , 79 ]. La plupart des recherches appliquées existantes concernent leur potentiel en tant qu’agents de lutte biologique [ 80 , 81 , 82 ]. Selon Abbas et al. [ 83 ], Steinernema carpocapsae est l’EPN le plus disponible, le plus polyvalent et le plus efficace, associé de manière mutualiste à Xenorhabdus nematophila , contre Rhynchophorus ferrugineus (Oliver, 1790) (Coleoptera Curculionidae). Des études récentes en laboratoire et en semi-terrain ont démontré l’efficacité de la combinaison de S. carpocapsae avec du chitosane contre R. ferrugineus sur un palmier Phoenix canariensis [ 33 ]. Selon ces résultats, tant dans Llácer et al. [ 33 ] que dans Dembilio et al. [ 34 ], le chitosane a activé les mécanismes de défense du palmier, augmentant la lignification et le développement des racines. La formulation de chitosane avec des nématodes, déjà brevetée en Espagne [ 84 ], a montré des résultats intéressants grâce à des essais curatifs (81,3 % de mortalité larvaire après 28 jours d’application) et des essais préventifs (98,2 % d’infestation au stade immature après 15 jours d’application) [ 33 ]. Conformément à ces résultats, Dembilio et al. [ 34 ] ont trouvé une mortalité de 99,7 % des stades immatures de R. ferrugineus dans un stipe de palmier traité avec S. carpocapsae formulé avec du chitosane.
2.6. Modification chimique du chitosane
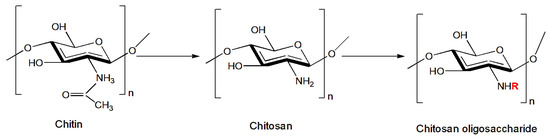
Étant donné que le chitosane lui-même n’a pas de propriétés toxiques, son utilisation contre les insectes nuisibles se fait généralement en tant qu’additif à d’autres substances toxiques. Néanmoins, son utilisation dans l’eau est souvent limitée en raison de ses liaisons hydrogène intermoléculaires et intramoléculaires, qui sont hautement cristallines, entravant la capacité du matériau à interagir avec les molécules d’eau [ 85 ]. Pour cette raison, la recherche s’est tournée vers l’étude de nouveaux dérivés et modifications chimiques du chitosane qui peuvent compenser ce manque de solubilité et de toxicité et améliorer ses propriétés physicochimiques afin d’élargir ses applications. Un exemple est l’oligosaccharide de chitosane (COS) ( Figure 1 ), qui est produit par diverses méthodes, y compris l’hydrolyse enzymatique et acide, qui convertit le chitosane en unités de faible poids moléculaire et lui confère la capacité d’être soluble dans les solutions aqueuses. Ces propriétés des oligosaccharides de chitosane améliorent également les activités biologiques du chitosane, comme le rapportent de nombreuses études. Français En particulier, les propriétés des dérivés du chitosane ont été étudiées contre certains insectes nuisibles à l’agriculture [ 86 , 87 , 88 ]. Zhang et al. [ 35 ] ont rapporté l’activité insecticide d’une solution d’oligosaccharides de chitosane pulvérisée sur les feuilles de plantes attaquées par certains des ravageurs les plus courants en agriculture, notamment les lépidoptères Helicoverpa armigera (Hübner, 1808) (Noctuidae) et P. xylostella et les hémiptères Aphididae Rhopalosiphum padi (Linnaeus, 1758)), Sitobion avenae (Fabricius, 1775), Metopolophium dirhodum (Walker, 1849), M. persicae , Hyalopterus pruni (Geoffroy, 1762) et Aphis gossypii (Glover, 1877). Les résultats obtenus en utilisant la solution de chitosane ont montré une activité insecticide de 40% pour H. armigera et de 72% pour P. xylostella après 72 h. Le traitement s’est avéré également efficace contre les pucerons, en particulier contre H. pruni (mortalité de 93%).
Figure 1. Formation de l’oligosaccharide de chitosane (COS). R est remplacé par H ou un groupe acétyle selon le degré de désacétylation (DD).
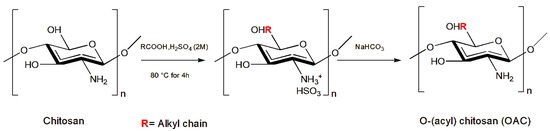
D’autres auteurs ont démontré que les dérivés du chitosane, avec l’introduction de groupes fonctionnels aux positions N- et O- ( Figure 2 ), présentent une biodégradabilité et une solubilité chimique améliorées dans l’eau ou les solvants organiques ainsi qu’améliorent les propriétés antimicrobiennes du chitosane [ 89 ].
Figure 2. Synthèse de l’OAC. Repensé à partir de [ 38 ].
Les nouveaux dérivés du chitosane, le N-alkyl chitosane (NAC), le N-benzyl chitosane (NBC) et le O-(acyl) chitosane (OAC), ont été administrés dans un régime alimentaire artificiel aux larves du lépidoptère Noctuidae Spodoptera littoralis (Boisduval, 1833). Parmi les dérivés du chitosane testés, le N-(2-chloro-6-fluorobenzyl) chitosane s’est avéré le plus efficace contre les larves de S. littoralis (CL 50 de 0,32 g/kg et CL 100 de 0,625 g/kg de régime), même si cela n’était pas statistiquement significatif [ 36 ]. De plus, le N-(propyl) chitosane, le N-(undécanyl) chitosane, le N-(3-phényl propyl) chitosane [ 37 ] et le O-(décanoyl) chitosane [ 38 ] ont montré une inhibition de la croissance larvaire avec des réductions de poids larvaire de 76, 66, 65 et 64 %, respectivement, après 4 jours d’administration, même si les résultats n’étaient pas statistiquement significatifs.
De plus, les complexes de chitosane avec des métaux modifient à la fois l’activité et les caractéristiques physicochimiques du chitosane ordinaire [ 90 ]. En tant qu’agent chélateur, le chitosane peut facilement former des complexes avec des métaux de transition ou lourds ( ). Les ions métalliques tels que Ag + , Cu 2+ , Zn 2+ et d’autres sont connus pour être des agents antimicrobiens [ 91 ]. À cet égard, certaines études se sont concentrées sur les propriétés antibactériennes des complexes chitosane-métal. En fait, dans Wang et al. [ 92 ], les complexes chitosane-métal ont montré des activités antimicrobiennes prononcées indiquant que l’effet inhibiteur des complexes chitosane-métal dépendait de la propriété des ions métalliques et de leur poids moléculaire. La connaissance du mode d’action de ces complexes contre les insectes a également été considérée comme d’un grand intérêt. Français Des complexes métalliques comme AgNO 3 , CuSO 4 -5H 2 O, NiCl 2 -6H 2 O et HgCl 2 ont été ajoutés à une solution de différents poids moléculaires de chitosane pour obtenir des complexes chitosane-métal qui ont ensuite été testés contre S. littoralis et Aphis nerii (Boyer de Fonscolombe, 1841) (Hemiptera Aphididae) [ 39 ]. Après 7 jours d’administration aux larves de S. littoralis , le chitosane à faible poids moléculaire (2,27 × 10 5 g/mol) incorporé dans le régime artificiel a présenté une mortalité larvaire de 50 %, tandis que les complexes Chitosane-Ni et Chitosane-Hg ont présenté une mortalité larvaire significativement plus élevée (93 et 83 %, respectivement) par rapport au témoin mais aussi aux autres complexes chitosane-métal. Français Au lieu de cela, pour A. nerii , les trois solutions de chitosane à différents poids moléculaires (2,27 × 10 5 , 3,60 × 10 5 et 5,97 × 10 5 g/mol) avaient toutes une efficacité significativement élevée (96, 87 et 100 %, respectivement) par rapport aux complexes chitosane-métal. Cependant, contre A. nerii , le complexe chitosane-Cu était le complexe chitosane-métal le plus efficace statistiquement, entraînant une mortalité de 94 % à 48 h.
Figure 3. Formation possible d’un complexe chitosane-métal. Repensé à partir de Wang et al. [ 92 ].
2.7. Nanoparticules de chitosane
Les nanoparticules polymères ont récemment gagné en popularité dans une grande variété de contextes, principalement dans le secteur agricole [ 15 , 93 , 94 ]. En particulier, les nanoparticules de chitosane sont étudiées comme vecteurs de substances actives, grâce à leurs systèmes de distribution contrôlée, et pour la stabilisation de composants biologiques tels que les protéines, les peptides ou le matériel génétique [ 95 ].
La gélification ionotropique, le complexe polyélectrolytique, la microémulsion, la diffusion de solvant en émulsion et la technique micellaire inverse sont les systèmes utilisés pour synthétiser les nanoparticules de chitosane. Cependant, les techniques les plus courantes sont les deux premières mentionnées ci-dessus [ 96 ].
Selon leur morphologie, les nanoparticules sont divisées en deux grands groupes : les nanosphères, structures solides à matrice homogène dans lesquelles le principe actif les enrobe uniformément à l’extérieur, et les nanocapsules, qui sont des structures creuses avec une membrane polymère et un noyau interne contenant le principe actif [ 97 ]
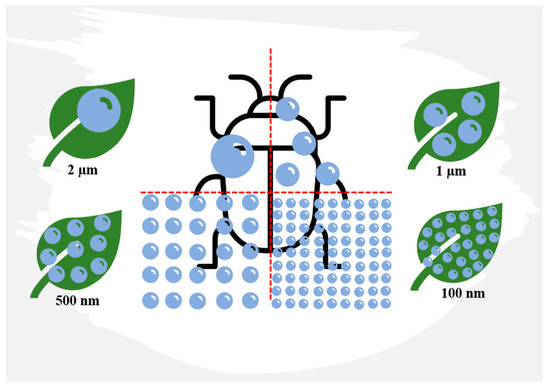
Avec des diamètres allant de 1 à 100 nm, la taille, la forme, la surface et le rapport surface/volume des nanoparticules sont des caractéristiques cruciales pour leur utilisation réussie dans la lutte antiparasitaire. La plus petite taille des nanoparticules ( Figure 4 ) assure une meilleure couverture, perméabilité et biodisponibilité du principe actif, et elle améliore également la solubilité dans l’eau des principes actifs autrement insolubles, la stabilité de la formulation, la capacité de libération lente, la résistance à la dégradation, la mobilité et une activité insecticide accrue. Par conséquent, les particules de taille nanométrique sont les plus couramment utilisées dans les formulations de chitosane [ 93 ].
Figure 4. Rapport entre la taille des particules et la surface à traiter. Plus la taille des particules est petite, meilleures sont la couverture, la perméabilité et la biodisponibilité de l’ingrédient actif comme outil de lutte antiparasitaire. Repensé d’après An et al. [ 94 ].
L’une des utilisations les plus courantes de cette formulation est le chargement de nanoparticules de chitosane avec des huiles essentielles pour augmenter la bioactivité et la stabilité des huiles. Dans Rajkumar et al. [ 20 ], des nanoparticules de chitosane chargées d’ huile essentielle de Piper nigrum ont été évaluées contre Tribolium castaneum (Herbst, 1797) (Coleoptera Tenebrionidae) et S. oryzae . Dans des tests de toxicité par fumigation, réalisés à l’aide d’un test sur papier imprégné [ 40 ], les nanoparticules de chitosane chargées d’ huile essentielle de P. nigrum ont montré une mortalité importante statistiquement significative après 24 h avec une CL 50 de 25,03 et 29,02 μL/L d’air pour S. oryzae et T. castaneum , respectivement, par rapport à l’huile essentielle pure (CL 50 de 48,97 et 55,77 μL/L d’air, respectivement). Français De plus, dans les bio-essais anti-appétants, les nanoparticules ont montré une plus grande protection des grains de blé contre les attaques de S. oryzae et T. castaneum (0 % de dommages observés pour les deux espèces) par rapport au témoin (74 % de dommages observés pour S. oryzae et 86 % pour T. castaneum ). La toxicité des nanoparticules de chitosane chargées d’huiles essentielles a été confirmée dans un travail ultérieur des mêmes auteurs [ 21 ], dans lequel des nanoparticules de chitosane chargées d’huiles essentielles de menthe poivrée (administrées selon la même méthodologie) ont montré un effet toxique similaire avec une CL 50 de 28,61 et 34,79 μL/L d’air contre S. oryzae et T. castaneum , respectivement, se révélant également plus efficaces par rapport au témoin (CL 50 de 56,48 et 62,94 μL/L d’air, respectivement). Français De même, les nanoparticules de chitosane chargées d’HE de Melissa officinalis ont montré une toxicité statistiquement significative plus élevée contre T. castaneum par fumigation (CL 50 de 0,048 μL/mL d’air) que le témoin (CL 50 de 0,071 μL/mL d’air). Le potentiel anti-alimentation des nanoparticules de chitosane chargées d’ HE de M. officinalis a été testé dans des bio-essais dédiés, qui ont révélé que T. castaneum était dissuadé de se nourrir sur les disques de farine traités (dissuasion maximale de 80 %) [ 41 ].
De plus, les nanoparticules de chitosane contribuent à une libération lente des HE et prolongent leur effet dans le temps, par rapport au produit pur. En effet, chez Soltani et co-auteurs [ 42 ], des tests de fumigation avec des nanocapsules de chitosane chargées d’ HE de Rosmarinus officinalis ont montré une prolongation de la mortalité dans le temps de T. castaneum (20 % de mortalité après 60 jours par rapport à l’HE pure après le même temps, à 2,1 %). Français Ces résultats ont été confirmés par Soltani et ses co-auteurs [ 43 , 44 ], qui ont rapporté que l’huile de romarin nanoencapsulée par du chitosane présentait une mortalité de 82 % et 50,7 % après 60 jours contre Oryzaephilus surinamensis (Linnaeus, 1758) (Coleoptera, Silvanidae) et Carpophilus hemipterus (Linnaeus, 1758) (Coleoptera, Nitidulidae) par rapport à l’HE pure (mortalité de 62 % et 19 %, respectivement). Suite à ces résultats, la nanoencapsulation d’HE dans le chitosane était plus efficace que l’HE pure, même au fil du temps.
Des nanoparticules de chitosane chargées d’huiles essentielles ont également été testées contre les moustiques, avec de bons résultats. En effet, les huiles essentielles d’Elettaria cardamomum et de Cinnamomum zeylanicum chargées dans des nanoparticules de chitosane ont montré une activité larvicide significative, après 24 h, contre Anopheles stephensi (Liston, 1901) (Diptera Culicidae), avec des valeurs de CL 50 de 7,58 et 2,98 μg/mL, respectivement [ 45 ]. Dans d’autres études, des nanoparticules de chitosane chargées d’huiles essentielles de Geranium maculatum et de Citrus bergamia ont montré une activité larvicide statistiquement significative contre Culex pipiens (Linnaeus, 1758) (Diptera Culicidae) avec des CL 50 de 22,63 et 38,52 ppm, respectivement, ainsi qu’une mortalité au fil du temps. En détail, la mortalité était supérieure à 50 % même 5 jours après le traitement [ 46 ].
Des résultats similaires ont été obtenus avec des nanoparticules de chitosane chargées d’ huile essentielle de Lippia sidoides , qui ont montré une activité larvicide significativement élevée après 3 jours (plus précisément 85 % après 24 h et 92 % après 48 et 72 h) contre Ae. aegypti [ 47 ]. De même, dans une autre étude, des nanoparticules de chitosane chargées d’ huile essentielle de Siparuna guianensis , à diverses concentrations, ont induit une mortalité larvaire significative d’ Ae. aegypti de manière dépendante du temps et de la dose [ 19 ]. Dans ce cas, tout d’abord, les larves de moustiques au stade larvaire ont été changées quotidiennement pendant 2 semaines pour observer l’effet des nanoparticules au fil du temps. Les nanoparticules préparées avec un rapport 1:2 de chitosane/EO ont montré une mortalité de 100 % après 2 jours à la concentration la plus faible (0,83 mg/mL), tandis que les nanoparticules avec le rapport 1:1 de chitosane/EO à la concentration la plus élevée (6,67 mg/mL) ont montré une mortalité de plus de 80 % même 2 semaines après le traitement.
Dans certains cas, les nanoparticules de chitosane chargées d’HE ou de leurs composés peuvent être attractives pour Bemisia tabaci (Gennadius, 1889) (Hemiptera, Aleyrodidae), avec un effet prolongé sur les ravageurs, comme le rapportent De Olivera et al. [ 49 ]. Dans les travaux de ces derniers, les nanoparticules de chitosane chargées de géraniol (5 mg/mL), l’un des principaux composants de certaines HE, ont produit un effet attractif stable même après 60 jours. Au contraire, Ferreira et al. [ 19 ], ont obtenu une toxicité élevée à 6,67 mg/mL de l’HE de S. guianensis chargée dans des nanoparticules de chitosane. En fait, il a été montré que la bioactivité des HE est vectorielle, c’est-à-dire qu’elle change de signe en fonction de l’HE et de la dose utilisée. La nanoencapsulation de quantités limitées d’huiles essentielles, qui entraîne également une libération contrôlée de leurs composants volatils, peut donc transformer la répulsion en attractivité [ 98 , 99 , 100 ]. Ces résultats suggèrent que la nanoencapsulation d’une petite quantité d’huiles essentielles dans le chitosane pourrait être utilisée dans des pièges potentiels.
Français Les extraits de plantes potagères possèdent des propriétés protectrices naturelles contre les ravageurs [ 101 ]. De plus, lorsqu’ils sont combinés avec des nanoparticules de chitosane, l’effet insecticide des extraits de plantes semble être renforcé. En fait, l’ajout de nanoparticules de chitosane chargées d’ extrait de feuille de Nerium oleander à un régime alimentaire artificiel a entraîné un effet larvicide statistiquement significatif contre M. domestica 48 h après l’exposition. La CL 50 était de 0,64 ppm, et il y a eu une réduction du taux de nymphose et de l’émergence des adultes de 27 % et 60 %, respectivement [ 48 ].
Les nanoparticules de chitosane ont également été utilisées comme nanotransporteurs pour les produits agrochimiques [ 102 ]. À cet égard, la nanoencapsulation de Poneem (un pesticide botanique contenant de l’huile de neem, de l’huile de Karanja, de l’azadirachtine et du Karanjin) dans le chitosane a été testée contre les larves d’H. amigera [ 18 ]. Les nanoparticules de chitosane ont été obtenues par tripolyphosphate (TPP) ou glutaraldéhyde (GLA), couramment utilisés comme agents de réticulation dans la préparation des nanoparticules de chitosane, augmentant leur stabilité. Le chitosane–TPP–Poneem et le chitosane–GLA–Poneem obtenus ont montré une activité anti-appétante significative des larves jusqu’à 88,5 et 72,3 %, respectivement, et une activité larvicide jusqu’à 90,2 % pour le chitosane–TPP–Poneem et 87,5 % pour le chitosane–GLA–Poneem. Comme certains des composés botaniques contenus dans les produits agrochimiques, ces nanoparticules ont induit des anomalies de croissance et de développement chez les larves et les pupes.
De plus, les nanoparticules de chitosane chargées de métabolites insecticides extraits de l’agent de lutte biologique fongique Nomuraea rileyi et pulvérisées sur les feuilles ont montré jusqu’à 99 % d’activité larvicide pour le quatrième stade larvaire de Spodoptera litura (Fabricius, 1775) (Lepidoptera Noctuidae) après 48 h de traitement [ 40 ].
Les nanoparticules de chitosane ont également été chargées d’insecticides commerciaux (Spinosad et Perméthrine), montrant un effet ovicide dose-dépendant significatif contre Drosophila melanogaster (Meigen, 1830) (Diptera Drosophilidae) [ 51 ].
Même les nanoparticules d’acide chitosane-g-polyacrylique, obtenues en greffant un monomère d’acide acrylique sur du chitosane et administrées sur des feuilles de ricin, influencent négativement le pourcentage de performance de croissance et d’émergence des adultes d’ A. gossypii (diminution de 77,8 % et 75 % de la croissance et de l’émergence des adultes par rapport au témoin) [ 52 ].
Français Au lieu de cela, l’acide nanochitosane-g-polyacrylique testé contre Cassida vittata (Villers, 1789) (Coleoptera Chrysomelidae) a montré une diminution statistiquement significative de la ponte par rapport au chitosane simple (3 ± 8,9 et 266 ± 8,7 œufs, respectivement). Le nouveau produit a également induit une mortalité des œufs de 100 % et une mortalité des larves de 91 % [ 53 ].
Des nanoparticules de chitosane auto-assemblées avec de l’acide myristique gras (NAMC–chitosane) chargées d’ huile essentielle de Cuminum cyminum ont été testées contre des insectes nuisibles alimentaires. Le composé auto-assemblé a montré, après 48 h, une mortalité significative de 100 % des adultes de Sitophilus granarius (Linnaeus, 1758) (Coleoptera Curculionidae) et de Tribolium confusum (Jaquelin du Val, 1863) (Coleoptera Tenebrionidae), avec une persistance de l’efficacité dans le temps (50 % de mortalité après 12 jours d’exposition pour S. granarius et 50 % après 24 jours pour T. confusum ) [ 54 ]. Ces résultats ont été confirmés dans une étude similaire par les mêmes auteurs, où le nanogel de NAMC–chitosane chargé d’ huile essentielle de Carum copticum a été testé contre la même espèce nuisible [ 55 ]. De plus, dans ce dernier cas, la mortalité s’est maintenue dans le temps, avec 89% et 80% de mortalité après 48 h pour S. granaries et T. confusum , respectivement, et 20% de mortalité après 12 jours pour S. granaries et 40% après 24 jours pour T. confusum .
Récemment, les nanoparticules de chitosane ont gagné en popularité en tant que composant de formulations de petits ARN interférents (siRNA) et d’ARN double brin (dsRNA) [ 15 ]. La nature cationique du chitosane permet l’application de nanoparticules de chitosane pour l’ARN interférent, un mécanisme non invasif par lequel des fragments d’ARN spécifiques (dsRNA et siRNA) sont capables de faire taire l’expression des gènes dans les larves de moustiques en se nourrissant [ 56 , 57 , 58 ]. En particulier, la technologie de l’ARN interférent utilisant des nanoparticules de chitosane a amélioré son efficacité en tant qu’outil de lutte antiparasitaire, en particulier pour Anopheles gambie (Giles, 1902) (Diptera Culicidae) et Ae. aegypti , en interférant avec la locomotion et les processus métaboliques responsables de la croissance et du développement.
3. Conclusions et perspectives d’avenir
Outre ses diverses propriétés et applications, le chitosane, dans ses différentes formulations, est également connu comme un outil de soutien (généralement comme matrice pour les composés à libération contrôlée) pour le contrôle de nombreuses espèces d’insectes nuisibles à l’agriculture, à l’alimentation et à la santé vétérinaire et publique.
Parmi les différentes formulations de chitosane (chitosane nature, enrobage et film de chitosane, chitosane et nématodes, modification chimique du chitosane, nanoparticules de chitosane chargées d’huiles essentielles, d’insecticides et de différents métabolites), l’ajout de chitosane aux huiles essentielles utilisées comme film d’enrobage s’est avéré une technologie prometteuse pour protéger les fruits, les légumes et les denrées alimentaires contre les insectes nuisibles et, dans la plupart des cas, préserver les caractéristiques organoleptiques et prolonger la durée de conservation des produits frais. Cette technique peut être utilisée pour développer des enrobages alimentaires protecteurs afin de décourager les attaques et la ponte des insectes nuisibles, mais aussi pour créer un matériau d’emballage actif capable de prévenir les infestations fongiques et de prolonger la durée de conservation des produits.
Comme indiqué dans de nombreux articles, la nanoencapsulation d’huiles essentielles dans une matrice de chitosane est également une formulation prometteuse contre les insectes nuisibles. En effet, les nanoparticules présentent une plus grande mobilité que les matériaux simples tels que les huiles essentielles ou les insecticides, ce qui se traduit par une meilleure pénétration dans les tissus des insectes et une activité insecticide accrue [ 103 ]. De plus, les nanoparticules à base de chitosane ont montré une augmentation du temps de libération des huiles essentielles ou des insecticides par rapport aux produits de départ, permettant une protection dans le temps même à des concentrations plus faibles. En particulier, les formulations de nanoparticules de chitosane chargées d’huiles essentielles pourraient être considérées comme les applications d’huiles essentielles les plus prometteuses grâce à leur respect de l’environnement, leur efficacité, leur protection dans le temps et leur effet de libération retardée.
Malheureusement, l’application du chitosane est limitée par sa faible solubilité, qui peut toutefois être améliorée par modification chimique, par exemple en introduisant des groupes hydrophiles dans sa chaîne macromoléculaire. En effet, les dérivés du chitosane NAC, NBC et OAC, dotés de groupes alkyle, benzyle et acyle, sont plus solubles que le chitosane simple et présentent surtout une activité insecticide supérieure. Parmi les différents types de chitosane modifié étudiés, tels que les oligosaccharides et les complexes chitosane-métal, certains pourraient être considérés comme adaptés en termes d’applicabilité, d’efficacité et de respect de l’environnement.
En conclusion, malgré les résultats positifs rapportés dans cet article et disponibles dans la littérature récente, les études sur l’effet de diverses formulations de chitosane sur les insectes nuisibles restent limitées. Grâce à cette revue, nous espérons fournir aux lecteurs des informations actualisées sur l’utilisation et les applications potentielles des formulations à base de chitosane comme outils de lutte antiparasitaire et susciter l’intérêt pour cette substance prometteuse.